Животный индикан. Определение индикана в моче. Две фазы биотрансформации ксенобиотиков
Содержание
Две фазы биотрансформации ксенобиотиков
Оба типа реакций совершенно самостоятельныи могут идти независимо друг от друга и в любом порядке. Для некоторых веществ после реакций 1 и 2I фазы вновь могут наступить реакции фазы 1.
Примером сочетанного превращения веществ может служить обезвреживание продукта метаболизма триптофана индолав животный индикан. Сначала индол окисляется с участием цитохрома Р450 до индоксила, затем конъюгирует с серной кислотой с образованием индоксилсульфата и далее калиевой соли – животного индикана.
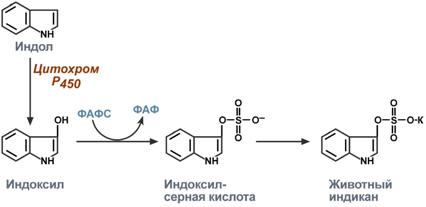
Превращение индола в 1 и 2 фазах биотрансформации
При повышенном поступлении индола из толстого кишечника образование индикана в печени усиливается, далее он поступает в почки и выводится с мочой. По концентрации животного индикана в моче можно судить об интенсивности процессов гниения белка в кишечнике.
Микросомы повышают реакционную способность молекул
Реакции микросомального окисления осуществляются несколькими ферментами, расположенными на мембранах эндоплазматического ретикулума (в случае in vitro они называются микросомальные мембраны). Ферменты организуют короткую цепь, которая заканчивается цитохромом P450. Цитохром Р450взаимодействует с молекулярным кислородом и включает один атом кислорода в молекулу субстрата, способоствуя появлению у нее гидрофильности, а другой – в молекулу воды.
Реакции микросомального окисления относятся к реакциям фазы 1 и предназначены для придания гидрофобной молекуле полярных свойств и/или для повышения ее гидрофильности, усиления реакционной способности молекул для участия в реакциях 2 фазы. В реакциях окисления происходит образование или высвобождение гидроксильных, карбоксильных, тиоловых и аминогрупп, которые и являются гидрофильными.
Ферменты микросомального окисления располагаются в гладком эндоплазматическом ретикулуме и являются оксидазами со смешанной функцией (монооксигеназами).
Основным белком этого процесса является гемопротеин – цитохром Р450. В природе существует до 150 изоформ этого белка, окисляющих около 3000 различных субстратов. У млекопитающих идентифицировано 13 подсемейств цитохрома Р450. Считается, что ферменты одних семейств участвуют в биотрансформации ксенобиотиков, других – метаболизируют эндогенные соединения (стероидные гормоны, простагландины, жирные кислоты и др.).
Работа цитохрома Р450 обеспечивается двумя ферментами:
· НАДН‑цитохром b5‑оксидоредуктаза, содержит ФАД,
· НАДФН‑цитохром Р450‑оксидоредуктаза, содержит ФМНи ФАД.
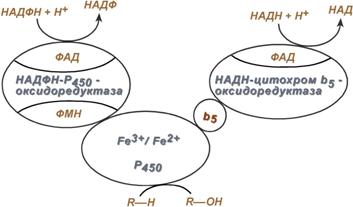
Схема взаиморасположения ферментов микросомального окисления и их функции
Обе оксидоредуктазы получают электроны от соответствующих восстановленных эквивалентов и передают их на цитохром Р450. Этот белок, предварительно присоединив молекулу восстановленного субстрата, связывается с молекулой кислорода. Получив еще один электрон, цитохром P450 осуществляет включение в состав гидрофобного субстрата первого атома кислорода (окисление субстрата). Одновременно происходит восстановление второго атома кислорода до воды.
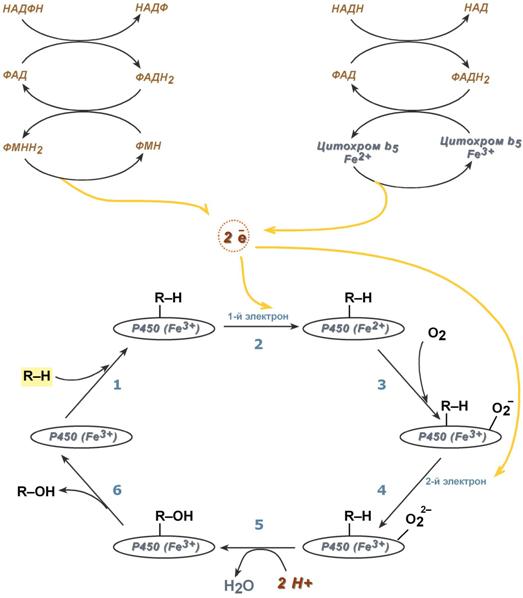
Реакции микросомального окисления
Существенной особенностью микросомального окисления является способность к индукции, т.е. увеличению мощности процесса. Индукторами являются вещества, активирующие синтез цитохрома Р450 и транскрипцию соответствующих мРНК. Классическим индуктором считаются производные барбитуровой кислоты –барбитураты. Поскольку существует много изоформ цитохрома, то имеется избирательность среди индукторов.
Ингибиторымикросомального окисления связываются с белковой частью цитохрома или с железом гема – например, спиронолактон, эритромицин.
Оценка реакций 1-й фазы
Оценку микросомального окисления можно проводить следующими способами:
· определение активности микросомальных ферментов после биопсии,
· по фармакокинетике препаратов,
· с помощью метаболических маркеров (антипирин).
Фазы метаболизма ксенобиотиков.
Метаболизм ксенобиотиков включает две стадии (фазы):
1) фаза модификации — процесс изменения структуры ксенобиотика, в результате которого освобождаются или появляются новые полярные группировки (гидроксильные, карбоксильные аминные). Это происходит в результате реакций окисления, восстановления, гидролиза. Образующиеся продукты становятся более гидрофильными, чем исходные вещества.
2) фаза конъюгации — процесс присоединения к молекуле модифицированного ксенобиотика различных биомолекул при помощи ковалентных связей. Это облегчает выведение ксенобиотиков из организма.
5.1. Фаза модификации. Основной тип реакций этой фазы биотрансформации — микросомальное окисление. Оно происходит при участии ферментов монооксигеназной цепи переноса электронов. Эти ферменты встроены в мембраны эндоплазматического ретикулума гепатоцитов (рисунок 1).
Источником электронов и протонов в этой цепи является НАДФН+Н + , который образуется в реакциях пентозофосфатного пути окисления глюкозы. Промежуточным акцептором Н + и е — служит флавопротеин, содержащий кофермент ФАД. Конечное звено в цепи микросомального окисления — цитохром Р-450.
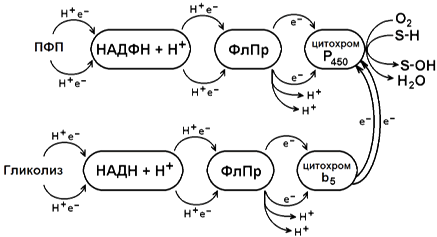
Цитохром P-450 — сложный белок, хромопротеин, в качестве простетической группы содержит гем. Своё название цитохром Р-450 получил в связи с тем, что образует прочный комплекс с оксидом углерода СО, имеющий максимум поглощения при 450 нм. Цитохром Р-450 обладает низкой субстратной специфичностью. Он может взаимодействовать с большим количеством субстратов. Общее свойство всех этих субстратов — неполярность.
Цитохром Р-450 активирует молекулярный кислород и окисляемый субстрат, изменяя их электронную структуру и облегчая процесс гидроксилирования. Механизм гидроксилирования субстратов с участием цитохрома Р-450 показан на рисунке 2.
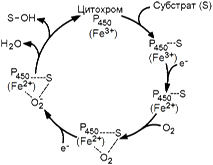
Рисунок 2. Механизм гидроксилирования субстрата при участии цитохрома Р-450.
В этом механизме условно можно выделить 5 основных этапов:
1. Окисляемое вещество (S) образует комплекс с окисленной формой цитохрома Р-450;
2. Происходит восстановление этого комплекса электроном с НАДФН;
3. Восстановленный комплекс соединяется с молекулой O 2 ;
4. О 2 в составе комплекса присоединяет ещё один электрон с НАДФН;
5. Комплекс распадается с образованием молекулы Н 2 О, окисленной формы цитохрома Р-450 и гидроксилированного субстрата (S-ОН).
В отличие от митохондриальной дыхательной цепи, при переносе электронов в монооксигеназной цепи не происходит аккумулирования энергии в виде АТФ. Поэтому микросомальное окисление является свободным окислением.
В большинстве случаев гидроксилирование чужеродных веществ снижает их токсичность. Однако в ряде случаев могут образоваться продукты с цитотоксическими, мутагенными и канцерогенными свойствами.
Примеры реакций, протекающих с участием цитохрома Р-450:
1) С-гидроксилирование алифатических соединений:

2) С-гидроксилирование ароматических соединений:

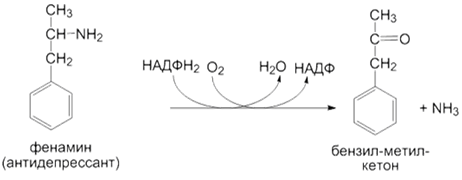
3) Окислительное дезаминирование субстратов:
4) N-деалкилирование субстратов:
5) O-деалкилирование субстратов:

6) S-деалкилирование субстратов:

7) N-окисление субстратов:

8) S-окисление субстратов: 
Некоторые окислительные реакции I фазы биотрансформации могут происходить без участия монооксигеназной цепи эндоплазматического ретикулума. Это реакции, которые катализируют ферменты: алкогольдегидрогеназа и альдегиддегидрогеназа (окисление алифатических спиртов), ксантиноксидаза (окисление производных пуринов), тирозингидроксилаза (образование катехоламинов), моноаминооксидаза (окисление биогенных аминов).
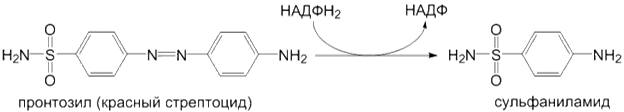
Реакции восстановления. Кроме окислительных реакций метаболизма ксенобиотиков, микросомальные ферментные системы катализируют реакции восстановления нитро- и азосоединений в амины. В качестве кофермента в этих реакциях участвует НАДФН 2 . Примером может служить реакция восстановления пронтозила в сульфаниламид:
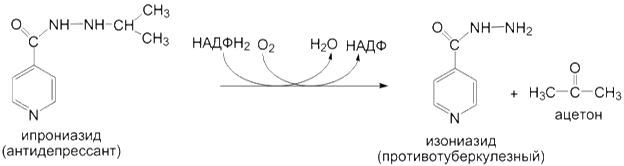
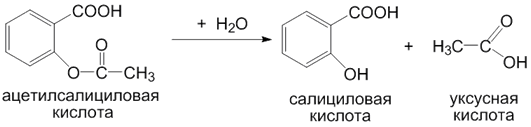
Реакции гидролиза. Микросомальные ферменты катализируют также гидролиз амидных и сложноэфирных связей в молекулах ксенобиотиков. В результате реакций гидролиза атропин превращается в тропин и троповую кислоту, а ипрониазид — в изоникотиновую кислоту и изопропилгидразин. Ещё одним примером является гидролиз ацетилсалициловой кислоты:
5.2. Реакции конъюгации ксенобиотиков. К реакциям конъюгации относятся глюкуронидная, сульфатная, ацетильная, метильная и пептидная конъюгация.
Глюкуронидная конъюгация. Реакцию катализирует глюкуронилтрансфераза, коферментом является активная форма глюкуроновой кислоты — уридин-дифосфоглюкуроновая кислота (УДФ-глюкуроновая кислота). В реакцию вступают спирты, фенолы, карбоновые кислоты, тиолы и амины. Из эндогенных субстратов можно отметить билирубин, стероидные гормоны, витамин D. Примером реакции может служить образование фенилглюкуронида:

Сульфатная конъюгация. Реакцию катализирует сульфотрансфераза. В качестве активной формы сульфата выступает З-фосфоаденозин-5-фосфосульфат (ФАФС). Субстратами чаще всего служат спирты и фенолы, реже — аминосоединения. В качестве примера реакции можно привести конъюгацию индоксила, который образуется в результате гидроксилирования индола(см. 33.5.1., реакции гидроксилирования ароматических соединений):

Продукт этой реакции в виде калиевой соли (животный индикан) выводится почками. Определение содержания индикана в моче может быть использовано для оценки интенсивности процессов гниения белков в кишечнике.
Ацетильная конъюгация. Ацетилированием называют присоединение к молекуле ксенобиотика или его метаболита остатка уксусной кислоты. Ацетилированию подвергаются вещества, содержащие свободную аминогруппу (алифатические и ароматические амины, аминокислоты, гидразины, гидразиды). Из эндогенных субстратов можно упомянуть аминосахара (глюкозамин, галактозамин) и биогенные амины.
Катализируют реакции ацетилирования ферменты ацетилтрансферазы, донором ацетильной группы является ацетил-КоА. Пример реакции — ацетилирование изониазида (изоникотиноилгидразида):

Метильная конъюгация (метилирование). Реакции метилирования (присоединения метильной группы) катализируют ферменты метилтрансферазы или трансметилазы. Донором метильной группы является активная форма аминокислоты метионина — S-аденозилметионин. Метилирование характерно для некоторых эндогенных субстратов (гуанидинацетат, норадреналин, фосфатидилэтаноламин). Субстратами для метилтрансфераз служат фенолы, тиолы и амины. Пример реакции — метилирование гистамина:
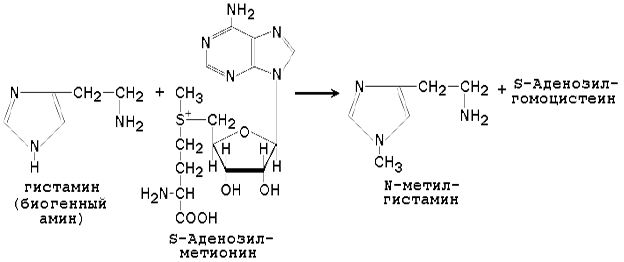
Метилирование ксенобиотиков по сравнению с другими реакциями конъюгации имеет одну особенность. В результате присоединения метильной группы продукт реакции не становится более гидрофильным. Тем не менее метильная конъюгация выполняет важную роль, так как в результате метилирования устраняются чрезвычайно реакционноспособные SH- и NН-группы.
Пептидная конъюгация — взаимодействие ксенобиотиков или их метаболитов с аминокислотами (глицин, глутамин, таурин и др.) при помощи пептидных (амидных) связей. Особенность этой разновидности конъюгации заключается в том, что ксенобиотик вступает в реакцию в активной форме (в других типах конъюгации активируется биомолекула). Пептидная конъюгация характерна для соединений, содержащих карбоксильные группы. Примером может служить конъюгация бензойной кислоты с глицином, в результате чего образуется гиппуровая кислота:
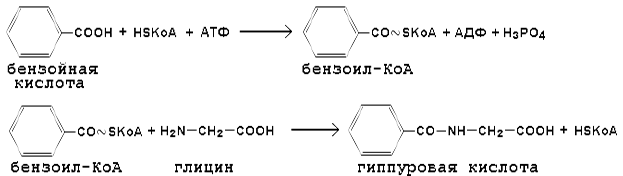
Эта реакция лежит в основе пробы Квика, используемой для оценки обезвреживающей функции печени.
В реакции конъюгации с глицином (H 2 N-CH 2 -COOH) и таурином (H 2 N-CH 2 -CH 2 -SO 3 H) вступают также желчные кислоты (например, холевая), образуя «парные соединения» или конъюгаты.
Большая часть токсинов обезвреживается в печени
Обезвреживание (детоксикация, биотрансформация) естественных метаболитов и чужеродных соединений (ксенобиотиков) непрерывно протекает в любом организме.
Токсичные и просто чужеродные вещества попадают в организм тремя путями: желудочно-кишечный тракт, легкие и кожа. Далее эти вещества либо могут подвергнуться каким-либо превращениям (биотрансформации) в легких и ЖКТ, либо перейти в кровь. С током крови любые соединения попадают в печень и другие органы. Если это водорастворимое вещество, то оно в состоянии профильтроваться в почках, если летучее – оказаться в выдыхаемом воздухе и покинуть организм, если жирорастворимое – оно либо фиксируется в тканях (кожа, нервная система, жировая ткань и т.п.), либо подвергается биотрансформации в печени. После превращений в печени модифицированное соединение направляется либо в желчь и далее в фекалии, либо в кровь и мочу.
Кожа также является органом выделения, хотя обычно эта функция проявляется слабо. Однако при нарушении выделительной функции почек и/или заболеваниях печени и желчевыделительной системы нагрузка на кожу возрастает, что может привести к ее косметическим нарушениям.
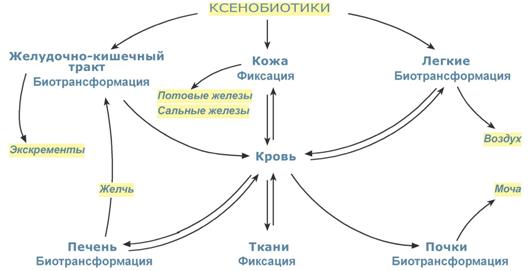
Места биотрансформации, задержки и выведения ксенобиотиков
Ксенобиотики – вещества, которые не используются как источник энергии, не встраиваются в структуры организма и не используются для пластических целей.
Например, биотрансформации в печени подвергаются следующие вещества:
- стероидные и тиреоидные гормоны, инсулин, адреналин,
- продукты распада гемопротеинов (билирубин),
- продукты жизнедеятельности микрофлоры, всасывающиеся из толстого кишечника при гниении белков – кадаверин (производное лизина), путресцин (производное аргинина), крезол и фенол (производное фенилаланина и тирозина) и других токсинов,
- ксенобиотики (токсины, лекарственные вещества и их метаболиты).
В целом все реакции биотрансформации делят на две группы или фазы:
- реакции 1 фазы – реакции превращения исходного вещества в более полярный метаболит путем введения или раскрытия функциональной группы (‑ОН, ‑NH2, ‑SH). Эти метаболиты часто неактивны, хотя в некоторых случаях активность не исчезает, а только изменяется. Если эти метаболиты достаточно полярны, они могут легко экскретироваться,
- реакции 2 фазы – отличительным признаком этой фазы являются реакции конъюгации с глюкуроновой, серной, уксусной кислотами, с глутатионом или аминокислотами.

Две фазы биотрансформации ксенобиотиков
Оба типа реакций совершенно самостоятельны и могут идти независимо друг от друга и в любом порядке. Для некоторых веществ после реакций 1-й и 2-й фазы вновь могут наступить реакции фазы 1.
Примером сочетанного превращения веществ может служить обезвреживание индола, продукта катаболизма триптофана в кишечнике, в животный индикан. Сначала индол окисляется с участием цитохрома Р450 до индоксила, затем конъюгирует с серной кислотой с образованием индоксилсульфата и далее калиевой соли – животного индикана.
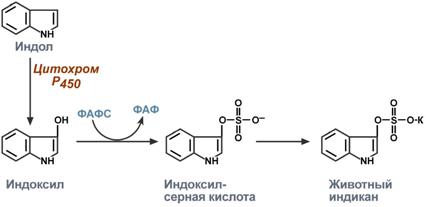
Превращение индола в 1 и 2 фазах биотрансформации
При повышенном поступлении индола из толстого кишечника образование индикана в печени усиливается, далее он поступает в почки и выводится с мочой. По концентрации животного индикана в моче можно судить об интенсивности процессов гниения белка в кишечнике.
Источники:
http://lektsia.com/3×5410.html
http://studopedia.info/7-20368.html
http://biokhimija.ru/biohimija-pecheni/obezvrezhivanie.html



